1 vial (11,7 ml) contiene 1400 mg de rituximab (1 ml contiene 120 mg de rituximab).
| Nombre | Contenido del paquete | La sustancia activa | Precio 100% | Última modificación |
| MabThera® | 1 vial de 11,7 ml, sol. por shock subs. | Rituximab | 2019-04-05 |
Acción
El rituximab es un anticuerpo monoclonal quimérico humano-murino producido por ingeniería genética. Es una inmunoglobulina glicosilada que contiene secuencias constantes de IgG1 humana y secuencias variables de cadena ligera y pesada de ratón. El anticuerpo se produce en una suspensión de células de ovario de hámster chino en cultivo y se purifica mediante cromatografía selectiva y métodos de intercambio iónico y procedimientos específicos de inactivación y eliminación de virus. Rituximab se une específicamente al antígeno transmembrana CD20, que es una fosfoproteína no glicosilada que se encuentra en los linfocitos pre-B y en los linfocitos B maduros. El dominio Fab de rituximab se une al antígeno CD20 en los linfocitos B y activa los mecanismos de lisis del sistema inmunológico a través del dominio Fc. B. Los posibles mecanismos de lisis celular incluyen citotoxicidad dependiente del complemento (CDC) asociada con la unión del componente C1q, y citotoxicidad celular dependiente de anticuerpos (ADCC) mediada por uno o más tipos de receptores Fcγ en la superficie de granulocitos, macrófagos y linfocitos NK. También se ha demostrado que la unión de rituximab al antígeno CD20 en los linfocitos B induce la muerte celular por apoptosis. Después de la administración subcutánea, rituximab se absorbe lentamente y alcanza la Cmax después de aproximadamente 3 días. La biodisponibilidad absoluta es aproximadamente del 71%. La exposición a rituximab aumenta la dosis proporcionalmente en el rango de dosis de 375 mg / m2 a 800 mg / m2 (administración subcutánea). Los parámetros farmacocinéticos (aclaramiento, volumen de distribución y semivida de eliminación) son similares para la formulación subcutánea y la formulación intravenosa. La mediana de eliminación estimada T0,5 para la administración subcutánea es de 29,7 días (rango de 9,9 a 91,2 días). El fármaco para administración subcutánea contiene hialuronidasa humana recombinante (rHuPH20), una enzima utilizada para aumentar la dispersión y absorción de fármacos coadministrados en el caso de inyección subcutánea.
Dosis
Por vía subcutánea. Adultos: 1400 mg independientemente de la superficie corporal del paciente. Antes de comenzar con rituximab solución inyectable debajo de la piel, todos los pacientes deben recibir primero la dosis completa de rituximab solución inyectable en una vena. Los pacientes que no hayan podido recibir una dosis intravenosa completa deben recibir una infusión de rituximab para los ciclos de tratamiento posteriores hasta que se haya administrado la dosis intravenosa completa. El cambio a la forma subcutánea del medicamento solo es posible en el segundo ciclo de tratamiento o en el siguiente. Linfomas foliculares no Hodgkin. Terapia de combinación. La dosis de rituximab en combinación con quimioterapia en el tratamiento de inducción de pacientes con linfoma folicular no Hodgkin no tratados previamente o en pacientes con linfoma folicular en recaída o refractario: en el primer ciclo, rituximab como solución para perfusión a una dosis de 375 mg / m2, seguido de rituximab solución inyectable debajo de la piel a una dosis fija de 1400 mg / ciclo durante hasta 8 ciclos consecutivos. Rituximab debe administrarse el día 1 de cada ciclo de quimioterapia después de la administración intravenosa del componente glucocorticoide de la quimioterapia, cuando corresponda. Cuidados de apoyo. Linfoma folicular no Hodgkin no tratado previamente: la dosis de mantenimiento recomendada de la solución inyectable subcutánea de rituximab para pacientes que responden al linfoma folicular no Hodgkin no tratado previamente es de 1400 mg cada 2 meses (a partir de los 2 meses). desde la última dosis de la terapia de inducción) hasta la progresión de la enfermedad o por un período máximo de 2 años (12 infusiones en total). Pacientes con linfoma folicular en recaída o refractario: la dosis recomendada de solución inyectable subcutánea de rituximab para la terapia de mantenimiento en pacientes con linfoma folicular en recaída o refractario que respondieron a la terapia de inducción es: 1.400 mg cada 3 meses (comenzando 3 meses después de la última dosis de la terapia de inducción) hasta la progresión de la enfermedad o durante un período máximo de 2 años (8 infusiones en total). Linfomas no Hodgkin difusos de células B grandes. El rituximab se debe utilizar en combinación con quimioterapia según el régimen CHOP (ciclofosfamida, doxorrubicina, vincristina, prednisolona). Para el primer ciclo, rituximab se administra como una infusión intravenosa de 375 mg / m2, seguida de una solución inyectable a una dosis constante de 1400 mg / ciclo debajo de la piel durante un total de 8 ciclos. Rituximab debe administrarse el día 1 de cada ciclo de quimioterapia, después de la administración intravenosa previa del componente glucocorticoide del régimen CHOP. No se ha establecido la seguridad y eficacia de rituximab en combinación con otros regímenes de quimioterapia en el tratamiento del linfoma no Hodgkin difuso de células B grandes. Modificaciones de dosis durante el tratamiento. No se recomienda la reducción de la dosis de rituximab. Deben usarse reducciones de dosis estándar para agentes quimioterapéuticos cuando el medicamento se usa en combinación con quimioterapia. Grupos especiales de pacientes. No se requiere ajuste de dosis en pacientes de edad avanzada (> 65 años). Aún no se ha establecido la seguridad y eficacia del fármaco en niños y adolescentes Forma de administración. El medicamento debe administrarse bajo la estrecha supervisión de un médico experimentado en un lugar donde todos los recursos necesarios para la reanimación estén disponibles de inmediato. Los pacientes deben ser observados durante un mínimo de 15 minutos después de la administración del fármaco y más tiempo en pacientes con mayor riesgo de reacciones de hipersensibilidad. Se debe administrar premedicación antipirética y antihistamínica (por ejemplo, paracetamol y difenhidramina) antes de cada administración de rituximab. Se debe considerar la premedicación con un glucocorticoide en pacientes con linfoma no Hodgkin que no reciben rituximab en combinación con quimioterapia que contiene glucocorticoides. Es importante comprobar la etiqueta del medicamento en todo momento para asegurarse de que se le administra el medicamento correcto para el paciente (intravenoso o subcutáneo) y la dosis. La solución de rituximab para inyección subcutánea solo debe administrarse mediante inyección subcutánea durante aproximadamente 5 minutos. La aguja hipodérmica debe colocarse en la jeringa inmediatamente antes de la administración para evitar obstrucciones. Inyectar por vía subcutánea solo en el abdomen (no hay datos disponibles para inyecciones en otras partes del cuerpo). Nunca lo use sobre áreas donde haya enrojecimiento, sensibilidad o endurecimiento de la piel, hematomas, lunares o cicatrices. Es mejor administrar otros medicamentos debajo de la piel durante el tratamiento con la preparación. Si se interrumpe la inyección, se puede reanudar en el mismo lugar o en uno diferente, si corresponde.
Indicaciones
Tratamiento del linfoma no Hodgkin (LNH) en adultos: tratamiento de pacientes con linfoma folicular en estadio III-IV sin tratamiento previo en combinación con quimioterapia; tratamiento de mantenimiento de pacientes con linfoma folicular no Hodgkin que han respondido a la terapia de inducción; tratamiento de pacientes con linfomas no Hodgkin difusos de células B grandes con antígeno CD20 positivo, en combinación con quimioterapia según el régimen CHOP (ciclofosfamida, doxorrubicina, vincristina, prednisolona).
Contraindicaciones
Hipersensibilidad al rituximab, hialuronidasa, cualquier otro ingrediente de la preparación o proteínas de ratón. Infecciones activas y graves. Pacientes en estado gravemente inmunodeprimido.
Precauciones
Para mejorar la trazabilidad de las preparaciones biológicas, el nombre comercial del medicamento administrado y el número de lote deben ingresarse claramente (o encerrarse en un círculo) en el expediente del paciente. No se debe recomendar el uso del fármaco como monoterapia en pacientes con linfoma folicular en estadio clínico III-IV, refractario a la quimioterapia o en la segunda o posterior recaída después de la quimioterapia, ya que no se ha establecido la seguridad de rituximab solución para inyección subcutánea. Una vez a la semana Debido al mayor riesgo de leucoencefalopatía multifocal progresiva (LMP), los pacientes que usan el fármaco deben ser monitoreados regularmente para detectar síntomas neurológicos o la aparición de síntomas que sugieran LMP. Si se sospecha de leucoencefalopatía multifocal progresiva, se debe interrumpir el tratamiento de inmediato hasta que se descarte un diagnóstico. Si existen dudas diagnósticas, se debe realizar una resonancia magnética con contraste, un examen del líquido cefalorraquídeo para determinar el ADN del virus JC y una reevaluación neurológica. Tenga especial cuidado ya que los síntomas de la leucoencefalopatía multifocal progresiva pueden pasar desapercibidos para el paciente. Si un paciente desarrolla síntomas de leucoencefalopatía multifocal progresiva, el tratamiento con la preparación debe interrumpirse de forma permanente. El tratamiento con la preparación está asociado con la aparición de reacciones relacionadas con el fármaco, que pueden estar asociadas con la liberación de citocinas y / u otros mediadores químicos. El síndrome de liberación de citocinas, el síndrome de lisis tumoral y las reacciones anafilácticas y de hipersensibilidad no están relacionados con la vía de administración y ocurren con la terapia con rituximab tanto intravenoso como subcutáneo. Todos los pacientes deben recibir primero la dosis completa de rituximab intravenoso antes de comenzar la administración subcutánea. El mayor riesgo de reacciones relacionadas con el fármaco se observa generalmente durante el primer ciclo de tratamiento, por lo que el inicio de la terapia con rituximab intravenoso proporcionará un alivio más eficaz de las reacciones adversas al ralentizar o interrumpir la perfusión. El síndrome de liberación de citocinas severo ocurre con mayor frecuencia dentro de las primeras o las primeras 2 horas después de comenzar la primera infusión. La preparación debe usarse con especial precaución en pacientes con una gran carga tumoral o con una gran cantidad (≥25 x 109 / l) de células tumorales circulantes, debido al mayor riesgo de síndrome de liberación de citocinas severo. Se debe considerar la posibilidad de reducir la velocidad de la primera perfusión en estos pacientes o dividir la dosis durante 2 días para el ciclo 1 y cada ciclo posterior si los recuentos de linfocitos siguen siendo> 25 x 109 / l. Los pacientes con antecedentes de insuficiencia respiratoria o infiltración pulmonar inducida por tumor tienen un riesgo particular de complicaciones y deben tratarse con mayor precaución. En pacientes que desarrollen un síndrome de liberación de citocinas severo, la perfusión debe suspenderse inmediatamente e instituirse un tratamiento sintomático intensivo. Como puede ocurrir un deterioro clínico después de una mejoría inicial, todos los pacientes deben ser monitoreados de cerca hasta que se descarten el síndrome de lisis tumoral y la infiltración pulmonar.Después de la administración intravenosa de productos proteicos, también pueden ocurrir reacciones anafilácticas u otras reacciones de hipersensibilidad (a diferencia del síndrome de liberación de citocinas, generalmente ocurren dentro de los primeros minutos después de comenzar la infusión); Los medicamentos para el tratamiento de reacciones de hipersensibilidad deben estar disponibles para uso inmediato durante la administración de rituximab. Las reacciones restantes, notificadas en unos pocos casos, incluyeron infarto de miocardio, fibrilación auricular, edema pulmonar y trombocitopenia aguda reversible. Debido a la posibilidad de hipotensión durante la infusión, se debe considerar la posibilidad de retirar los medicamentos antihipertensivos 12 horas antes de la infusión de rituximab. La administración subcutánea se ha asociado con el desarrollo de reacciones cutáneas leves o moderadas (grado 1 o 2), que generalmente se resuelven sin tratamiento específico. El tratamiento con rituximab debe interrumpirse de forma permanente en caso de reacciones cutáneas graves como el síndrome de Stevens-Johnson o la necrólisis epidérmica tóxica. Debe usarse con precaución en pacientes con un recuento de neutrófilos de 9 / ly / o un recuento de plaquetas de 9 / l, debido a la limitada experiencia clínica en estos pacientes. Los recuentos sanguíneos completos, incluidos los recuentos de neutrófilos y plaquetas, deben controlarse periódicamente durante el tratamiento. Se debe tener especial cuidado al considerar el uso de la preparación en pacientes con antecedentes de infecciones recurrentes o crónicas y en pacientes con enfermedades subyacentes que podrían predisponer a los pacientes a infecciones graves. El uso de rituximab puede asociarse con la reactivación de la hepatitis B (con riesgo de hepatitis fulminante con desenlace fatal), tanto en pacientes HBsAg + ve (HBsAg + ve) como HBsAg + ve negativos. , pero se ha detectado un anticuerpo anti-antígeno central anti-HB (HBsAg-ve / HBcAb + ve), especialmente cuando el fármaco se administra en combinación con glucocorticoides o quimioterapia. Todos los pacientes deben someterse a pruebas de detección de hepatitis B, incluidas al menos las pruebas de HBsAg y HBcAb, antes de iniciar el tratamiento con rituximab. Los diagnósticos deben complementarse con la evaluación de otros marcadores de infección de acuerdo con las recomendaciones locales. Los pacientes con infección activa por hepatitis B no deben ser tratados con rituximab. Los pacientes que sean serológicamente positivos para la infección por VHB-HBsAg y / o HBcAb (pero sin un estado de enfermedad activo conocido) antes de comenzar la terapia con rituximab deben ser consultados por un especialista en enfermedades infecciosas antes de ser monitoreados y monitoreados de cerca de acuerdo con los estándares locales. para prevenir la reactivación de la infección por hepatitis B. Debido al mayor riesgo de cardiotoxicidad, los pacientes con antecedentes de enfermedad cardíaca y aquellos que han recibido quimioterapia cardiotóxica deben ser monitoreados de cerca.
Actividad indeseable
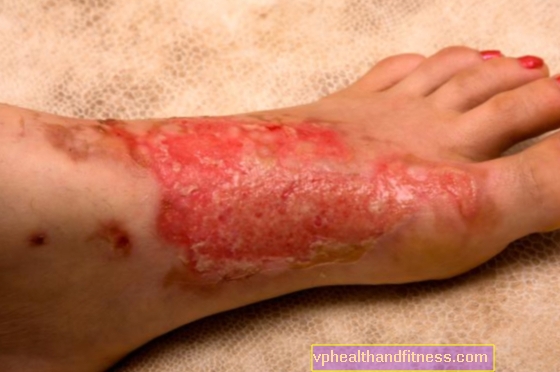
El perfil de seguridad de la solución de rituximab para inyección subcutánea es similar al de la formulación intravenosa, con la excepción de las reacciones cutáneas locales. Las reacciones cutáneas locales son muy frecuentes en pacientes que reciben rituximab por vía subcutánea. Las reacciones cutáneas locales más frecuentes son eritema (13%), dolor en el lugar de la inyección (7%) e hinchazón en el lugar de la inyección (4%). Los eventos adversos posteriores a la administración subcutánea son de leves a moderados. Las reacciones medicamentosas subcutáneas graves (grado ≥3) pueden incluir erupción de grado 3 en el lugar de la inyección y sequedad de boca. Las reacciones cutáneas locales de cualquier grado ocurren con mayor frecuencia durante el primer ciclo, luego el segundo ciclo, y disminuyen con cada inyección subsiguiente. Los siguientes son efectos secundarios notificados con el uso de rituximab intravenoso en pacientes con linfoma no Hodgkin (LNH) y leucemia linfocítica crónica (LLC), ya sea solo o en combinación con quimioterapia. Las reacciones adversas a medicamentos (RAM) graves notificadas con más frecuencia fueron las reacciones relacionadas con la infusión (incluido el síndrome de liberación de citocinas, el síndrome de lisis tumoral), las infecciones y los eventos cardiovasculares. Otras reacciones adversas graves notificadas fueron: infecciones víricas graves, incluidas infecciones causadas por virus del herpes (citomegalovirus, virus de la varicela-zóster y virus del herpes), virus de la hepatitis C, virus de la hepatitis B, virus JC (Leucoencefalopatía multifocal progresiva - LMP): se han informado muertes. En pacientes con sarcoma de Kaposi preexistente tratados con rituximab, se ha observado progresión tumoral en pacientes con indicaciones no aprobadas y la mayoría de los pacientes eran VIH positivos. Muy frecuentes: infección bacteriana, infección viral, bronquitis, neutropenia, leucopenia, neutropenia febril, trombocitopenia, efectos secundarios relacionados con la perfusión, angioedema, náuseas, prurito, erupción cutánea, alopecia, pirexia, escalofríos, astenia, dolor de cabeza, disminución de la presión arterial. IgG. Frecuentes: sepsis, neumonía, infección febril, herpes zóster, infecciones del tracto respiratorio, infecciones por hongos, infecciones de etiología desconocida, bronquitis aguda, sinusitis, hepatitis B (incluidas infecciones primarias y reactivación de la hepatitis B, más común en pacientes). recibiendo rituximab en combinación con quimioterapia citotóxica), anemia, anemia aplásica, granulocitopenia, hipersensibilidad, hiperglucemia, pérdida de peso, edema periférico, edema facial, aumento de LDH, hipocalcemia, parestesia, hipoestesia, agitación, insomnio, dolor de cabeza, vasodilatación, mareos ansiedad, trastorno lagrimal, conjuntivitis, tinnitus, dolor de oído, infarto de miocardio (incluidos casos raramente notificados con desenlace fatal), arritmia, fibrilación auricular, taquicardia, trastornos cardíacos, hipertensión, hipotensión ortostática, presión arterial baja, broncoespasmo (incluyendo raras veces casos mortales notificados), enfermedades respiratorias, dolor l Pecho, disnea, aumento de la tos, rinitis, vómitos, diarrea, dolor abdominal, disfagia, estomatitis, estreñimiento, indigestión, anorexia, irritación de garganta, urticaria, sudoración, sudores nocturnos, trastornos de la piel, tensión muscular, dolor dolor muscular, artralgia, dolor de espalda, dolor de cuello, dolor, dolor tumoral, enrojecimiento, malestar, síndrome del resfriado, fatiga, escalofríos, insuficiencia multiorgánica (incluidos casos raros con desenlace fatal). Poco frecuentes: trastornos de la coagulación, anemia aplásica, anemia hemolítica, linfadenopatía, depresión, nerviosismo, disgeusia, insuficiencia ventricular izquierda, taquicardia supraventricular, taquicardia ventricular, angina de pecho, isquemia miocárdica, bradicardia, asma, bronquiolitis obliteración, hipoxia, trastornos abdomen agrandado, dolor en el lugar de la inyección. Raras: infecciones víricas graves, anafilaxia, acontecimientos cardíacos graves (incluidos casos mortales notificados raramente), enfermedad pulmonar intersticial (incluidos casos mortales) Muy raras: aumento transitorio de IgM sérica, síndrome de lisis tumoral y síndrome de liberación de citocinas (incluidos los casos notificados raramente con desenlace fatal), enfermedad del suero, neuropatía periférica, parálisis del nervio facial, pérdida grave de la visión, insuficiencia cardíaca (incluidos casos raramente notificados con fatal), vasculitis (predominantemente cutánea), vasculitis leucocitoclástica, insuficiencia respiratoria (incluidos los casos notificados raramente con desenlace fatal), perforación gástrica o intestinal (incluidos los casos fatales), reacciones cutáneas graves tipo ampollas (síndrome de Stevens-Johnson y necrólisis epidérmica tóxica, incluidos los casos mortales), insuficiencia renal (incluidos los casos notificados raramente con desenlace mortal). Frecuencia no conocida: neutropenia tardía, trombocitopenia aguda reversible relacionada con la infusión, neuropatía craneal, pérdida de otros sentidos, pérdida de audición, infiltrados pulmonares. Se ha notificado síndrome de encefalopatía posterior reversible (SEPR) (que ocurre en pacientes con factores de riesgo conocidos de SEPR, que incluyen enfermedad subyacente, hipertensión, terapia inmunosupresora y / o quimioterapia).
Embarazo y lactancia
El medicamento no debe usarse en mujeres embarazadas, excepto en los casos en que los posibles beneficios superen el riesgo potencial (existe el riesgo de una reducción en la cantidad de linfocitos B y el desarrollo de linfocitopenia en los recién nacidos). Las mujeres en edad fértil deben utilizar métodos anticonceptivos eficaces tanto durante el tratamiento como durante los 12 meses posteriores al mismo. No debe amamantar durante el tratamiento con la preparación y durante los 12 meses posteriores a su finalización.
Comentarios
El fármaco no afecta la capacidad para conducir y utilizar máquinas. La preparación debe almacenarse a 2-8 ° C. Información preparada sobre la base de SPC de 26/04/2018 El RCP actual está disponible en www.roche.pl.
Interacciones
Actualmente, existen datos limitados sobre las interacciones medicamentosas con rituximab. Rituximab no afectó la farmacocinética de fludarabina o ciclofosfamida. Tampoco hubo efecto de fludarabina o ciclofosfamida sobre la farmacocinética de rituximab. Los pacientes con anticuerpos humanos anti-murinos o anti-quiméricos (HAMA / HACA) pueden desarrollar reacciones alérgicas o de hipersensibilidad después de la administración de otros anticuerpos monoclonales con fines diagnósticos o terapéuticos.
La preparación contiene la sustancia: Rituximab
Medicamento reembolsado: NO





.jpg)