1 vial (1,5 ml) de concentrado contiene 60 mg de cabazitaxel. Después de la dilución inicial con todo el volumen del disolvente, 1 ml de la solución contiene 10 mg de cabazitaxel. El vial de disolvente contiene 573,3 mg de etanol al 96%.
| Nombre | Contenido del paquete | La sustancia activa | Precio 100% | Última modificación |
| Jevtan | 1 vial 1,5 ml final + 1 vial 4,5 ml reconstituido, final y reconstituido para preparación solución a inf. | Cabazitaxel | 2019-04-05 |
Acción
Medicamento contra el cáncer. Actúa interrumpiendo la red de microtúbulos en las células, se une a la tubulina y estimula la deposición de la tubulina en los microtúbulos, al tiempo que inhibe su degradación. Conduce a la estabilización de los microtúbulos, lo que inhibe la división celular mitótica y en interfase. Cabazitaxel exhibe un amplio espectro de actividad antitumoral contra tumores humanos avanzados en ratones implantados. Es activo contra neoplasias sensibles al docetaxel y no susceptible a la quimioterapia que contiene docetaxel. Se metaboliza en el hígado (> 95%), principalmente a través de la isoenzima CYP3A4 (80-90%). Se elimina principalmente en las heces en forma de numerosos metabolitos (76% de la dosis; la excreción renal representa menos del 4% de la dosis). Se une a las proteínas séricas en un 89-92%. T0,5 en la fase de eliminación es de 95 h.
Dosis
Por vía intravenosa. Adultos. El medicamento solo debe usarse en unidades especializadas en la administración de medicamentos citotóxicos y debe administrarse solo bajo la supervisión de un médico calificado en el uso de quimioterapia contra el cáncer.Para reducir el riesgo de desarrollar y agravar reacciones de hipersensibilidad, el régimen de premedicación recomendado debe realizarse al menos 30 minutos antes de cada administración de fármaco mediante la administración intravenosa de las siguientes preparaciones: antihistamínico (5 mg de dexclorfeniramina o 25 mg de difenhidramina o un fármaco de potencia equivalente), corticosteroide (8 mg de dexametasona o un fármaco con potencia equivalente) y un antagonista del receptor H2 (ranitidina o un fármaco con potencia equivalente). Se recomienda utilizar antieméticos profilácticos, que pueden administrarse por vía oral o intravenosa según sea necesario. Los pacientes deben estar adecuadamente hidratados durante el tratamiento. La dosis recomendada es de 25 mg / m2. administrado como una infusión intravenosa de 1 hora cada 3 semanas, en combinación con prednisona oral o 10 mg de prednisolona administrados diariamente durante el tratamiento. La dosis debe ajustarse si los pacientes desarrollan las siguientes reacciones adversas: Neutropenia de grado ≥3 a largo plazo (más de 1 semana) a pesar del tratamiento adecuado, incluido G-CSF; el tratamiento debe retrasarse hasta que el recuento de neutrófilos sea> 1500 células / mm3. y luego reducir la dosis de cabazitaxel de 25 mg / m2. hasta 20 mg / m2 de superficie corporal; Neutropenia febril o infección neutropénica: el tratamiento debe retrasarse hasta que los síntomas mejoren o se resuelvan y el recuento de neutrófilos sea> 1500 células / mm3, luego se debe reducir la dosis de cabazitaxel de 25 mg / m2. hasta 20 mg / m2 de superficie corporal; Diarrea de grado ≥3. o diarrea que persiste a pesar del tratamiento adecuado, incluido el reemplazo de líquidos y electrolitos; el tratamiento debe retrasarse hasta que los síntomas mejoren o se resuelvan, y luego reducir la dosis de cabazitaxel de 25 mg / m2. hasta 20 mg / m2 de superficie corporal; Neuropatía periférica de grado> 2 - El tratamiento debe retrasarse hasta que mejore, luego reducir la dosis de cabazitaxel de 25 mg / m2. hasta 20 mg / m2 El tratamiento debe suspenderse si el paciente continúa experimentando alguno de los efectos secundarios descritos a la dosis de 20 mg / m2. Grupos especiales de pacientes. En pacientes con insuficiencia hepática leve (bilirrubina total> 1 a ≤ 1,5 límite superior de la normalidad (LSN) o AST> 1,5 x LSN), la dosis de cabazitaxel debe reducirse a 20 mg / m2. Se debe tener precaución y la seguridad de cabazitaxel administrado en pacientes con insuficiencia hepática leve. En pacientes con insuficiencia hepática moderada (bilirrubina total> 1,5 a ≤ 3 x LSN), la dosis máxima tolerada es de 15 mg / m2. En el tratamiento de pacientes con insuficiencia hepática moderada, la dosis de cabazitaxel no debe exceder los 15 mg / m2. Cabazitaxel no debe administrarse a pacientes con insuficiencia hepática grave (bilirrubina total> 3 x LSN). No se requiere ajuste de dosis en pacientes con insuficiencia renal que no requieran hemodiálisis. En pacientes con enfermedad renal terminal (aclaramiento de creatinina (método de administración CLCR), no se deben utilizar bolsas de infusión de PVC ni equipos de infusión de poliuretano.
Indicaciones
El fármaco en combinación con prednisona o prednisolona está indicado para el tratamiento de pacientes con cáncer de próstata metastásico resistente a hormonas tratados previamente con un régimen de quimioterapia que contiene docetaxel.
Contraindicaciones
Hipersensibilidad al cabazitaxel, a otros taxanos oa alguno de los excipientes, incluido el polisorbato 80. Recuento de neutrófilos por debajo de 1500 / mm3. Insuficiencia hepática (bilirrubina total ≥ 3 x LSN). Vacunación concomitante con vacuna contra la fiebre amarilla.
Precauciones
Todos los pacientes deben recibir premedicación antes de iniciar una perfusión de cabazitaxel. Se debe controlar a los pacientes para detectar la aparición de reacciones de hipersensibilidad (especialmente durante la 1ª y 2ª perfusión; pueden producirse reacciones de hipersensibilidad graves: erupción generalizada, eritema, hipotensión, broncoespasmo); en caso de una reacción de hipersensibilidad, suspenda el uso del medicamento. Los pacientes tratados con cabazitaxel pueden recibir G-CSF profiláctico de acuerdo con las recomendaciones de la Sociedad Americana de Oncología Clínica y / o las pautas actuales del centro para reducir el riesgo o manejar las complicaciones de la neutropenia. Se debe considerar la profilaxis primaria con G-CSF en pacientes con características clínicas de alto riesgo (edad> 65 años, mal estado funcional, episodios previos de neutropenia febril, áreas extensas del cuerpo previamente irradiadas, estado nutricional deficiente u otras comorbilidades graves) que predisponen para aumentar las complicaciones de la neutropenia prolongada. Se ha demostrado que el uso de G-CSF reduce la incidencia y la gravedad de la neutropenia. Se deben realizar recuentos sanguíneos completos cada semana durante el ciclo 1 y antes de cada ciclo posterior para que la dosis pueda ajustarse si es necesario. La dosis debe reducirse en caso de neutropenia febril o neutropenia prolongada a pesar del tratamiento adecuado. Los pacientes solo deben volver a tratarse después de que su recuento de neutrófilos vuelva a ≥ 1500 / mm3. Los síntomas como dolor y sensibilidad abdominal, fiebre, estreñimiento persistente, diarrea con o sin neutropenia pueden ser signos tempranos de toxicidad gastrointestinal grave, que deben evaluarse y tratarse de inmediato, y es posible que sea necesario retrasar o suspender la terapia con cabazitaxel. Si los pacientes desarrollan diarrea, pueden tratarse con medicamentos antidiarreicos de uso común. Los pacientes que previamente han recibido irradiación en el área abdominal y pélvica tienen un mayor riesgo de diarrea. La deshidratación es más común en pacientes ≥ 65 años. Se deben tomar acciones para rehidratar al paciente y para monitorear y corregir los electrolitos séricos, especialmente el potasio. Con diarrea de grado ≥3. es posible que sea necesario posponer el tratamiento o reducir la dosis. Si los pacientes desarrollan náuseas o vómitos, pueden tratarse con antieméticos de uso común. En pacientes tratados con cabazitaxel se han notificado hemorragia gastrointestinal y perforación gastrointestinal, obstrucción intestinal paralítica, colitis, incluida colitis mortal Se recomienda precaución al tratar pacientes con mayor riesgo de complicaciones gastrointestinales: en pacientes con neutropenia, ancianos edad, usando concomitantes antiinflamatorios no esteroideos, terapia antiplaquetaria, terapia anticoagulante, en pacientes con radioterapia pélvica previa o en pacientes con enfermedades gastrointestinales como úlceras gastrointestinales y hemorragias. Se debe evaluar la presencia o el empeoramiento de la neuropatía antes de cualquier tratamiento; el tratamiento debe retrasarse hasta que mejoren los síntomas y en caso de neuropatía periférica persistente de Grado> 2. reducir la dosis de la droga. La creatinina sérica debe medirse antes de iniciar el tratamiento, durante todas las pruebas de hemograma y siempre que un paciente informe un cambio en el volumen de orina. El fármaco debe suspenderse en caso de insuficiencia renal de CTCAE 4.0 grado ≥3. Se debe tener precaución en pacientes de edad avanzada (≥ 65 años de edad) debido a un mayor riesgo de reacciones adversas que incluyen neutropenia y neutropenia febril, y en pacientes con un nivel de hemoglobina de 3 x LSN). La dosis debe reducirse en pacientes con insuficiencia hepática leve (bilirrubina total> 1 a ≤1,5 x LSN o AST> 1,5 x LSN). Debe evitarse el uso concomitante de inhibidores potentes del CYP3A, ya que pueden aumentar la concentración plasmática de cabazitaxel. Debe evitarse el uso concomitante de inductores potentes de CYP3A4, ya que pueden disminuir las concentraciones plasmáticas de cabazitaxel. El disolvente contiene 573,3 mg de etanol al 96% (15% v / v), correspondiente a 14 ml de cerveza o 6 ml de vino, esto debe tenerse en cuenta en personas que padecen alcoholismo y pacientes con enfermedades hepáticas o epilepsia.
Actividad indeseable
Efectos secundarios y trastornos hematológicos en pacientes que reciben el preparado en combinación con prednisona o prednisolona. Muy frecuentes: neutropenia, anemia, leucopenia, trombocitopenia, anorexia, disgeusia, disnea, tos, diarrea, náuseas, vómitos, estreñimiento, dolor abdominal, alopecia, dolor de espalda, artralgia, hematuria, fatiga, astenia, fiebre. Frecuentes: choque séptico, sepsis, celulitis, infección del tracto urinario, influenza, cistitis, infección del tracto respiratorio superior, herpes, micosis, neutropenia febril, hipersensibilidad, deshidratación, hiperglucemia, hipopotasemia, inquietud, estado de confusión, neuropatía periférica, periférico neuropatía sensorial, mareos, dolor de cabeza, parestesia, letargo, hipoestesia, ciática, conjuntivitis, aumento del lagrimeo, tinnitus, vértigo, fibrilación auricular, taquicardia, hipotensión, trombosis venosa profunda, hipotensión ortostática, hipotensión , sofocos, enrojecimiento paroxístico de la piel, dolor orofaríngeo, neumonía, indigestión, dolor abdominal superior, hemorroides, enfermedad por reflujo gastroesofágico, sangrado rectal, boca seca, flatulencia, piel seca, eritema, dolor en las extremidades, espasmo muscular , dolor muscular, dolor torácico musculoesquelético dolor elet, dolor lateral del cuerpo, insuficiencia renal aguda, insuficiencia renal, dificultad para orinar, cólico renal, polaquiuria, hidronefrosis, retención urinaria, incontinencia urinaria, obstrucción ureteral, dolor pélvico, edema periférico, mucositis, dolor, dolor de pecho tórax, edema, escalofríos, malestar general, pérdida de peso, aumento de AST, aumento de transaminasas. En un ensayo clínico, el 18,3% de los pacientes interrumpieron el tratamiento debido a efectos secundarios; la reacción adversa más común que provocó la interrupción del tratamiento fue la neutropenia (2,4%). Incidencia de neutropenia de grado ≥3. según los resultados de las pruebas de laboratorio, fue del 81,7%. La incidencia de neutropenia clínica de grado ≥3 y neutropenia febril fue del 21,3% y del 7,5%, respectivamente. Las complicaciones neutropénicas incluyeron infección neutropénica, sepsis neutropénica y choque séptico, en algunos casos con desenlace fatal. La incidencia de anemia de grado ≥3, AST, ALT y bilirrubina aumentada según los hallazgos de laboratorio fue del 10,6%, 0,7%, 0,9% y 0,6%, respectivamente. Las siguientes reacciones adversas, con una frecuencia ≥5%, se notificaron con mayor frecuencia en pacientes ≥65 años en comparación con pacientes más jóvenes: fatiga, neutropenia clínica, astenia, pirexia, mareos, infecciones del tracto urinario y deshidratación. La frecuencia de las siguientes reacciones adversas de grado ≥3. fue mayor en pacientes ≥65 años en comparación con pacientes más jóvenes: neutropenia de laboratorio, neutropenia clínica y neutropenia febril.
Embarazo y lactancia
No hay datos sobre el uso de cabazitaxel en mujeres embarazadas. Los estudios en animales han demostrado toxicidad para la reproducción a dosis maternotóxicas y la penetración de cabazitaxel a través de la barrera placentaria, por lo tanto, cabazitaxel puede dañar al feto en mujeres embarazadas expuestas; no use el medicamento durante el embarazo y en mujeres en edad fértil que no utilicen métodos anticonceptivos eficaces. El medicamento no debe usarse durante la lactancia. No se puede descartar un efecto de cabazitaxel sobre la fertilidad masculina, por lo que se deben utilizar métodos anticonceptivos eficaces durante el tratamiento y hasta 6 meses después de la última dosis. Los pacientes varones que reciben cabazitaxel deben evitar el contacto de otras personas con su eyaculación durante el tratamiento y deben considerar el almacenamiento de esperma antes del tratamiento.
Comentarios
El fármaco puede afectar su capacidad para conducir o utilizar máquinas, ya que provoca cansancio y mareos. Se debe indicar a los pacientes que no conduzcan ni utilicen maquinaria si experimentan estos efectos secundarios durante el tratamiento.
Interacciones
Los estudios in vitro han demostrado que cabazitaxel es metabolizado principalmente por CYP3A e inhibe. El uso concomitante de inhibidores potentes del CYP3A (p. Ej., Ketoconazol, itraconazol, claritromicina, atazanavir, indinavir, nefazodona, nelfinavir, ritonavir, saquinavir, telitromicina, voriconazol) presumiblemente aumenta la concentración de cabazitaxel y debe evitarse con precaución el uso de inhibidores potentes del CYPitaxel en combinación con CYPitaxel. Inhibidores de CYP3A. Es probable que el uso concomitante de inductores potentes de CYP3A (por ejemplo, fenitoína, carbamazepina, rifampicina, rifabutina, rifapentina, fenobarbital) disminuya las concentraciones de cabazitaxel; debe evitarse el uso concomitante de inductores potentes de CYP3A. Los pacientes no deben tomar preparados que contengan hierba de San Juan. También se ha demostrado que el cabazitaxel inhibe el grupo polipéptido OATP1B1 transportador de aniones orgánicos. El riesgo de interacción con los sustratos de OATP1B1 (por ejemplo, estatinas, valsartán, repaglinida) es posible, especialmente durante el tiempo de perfusión (1h) y hasta 20 minutos. después del final de la infusión. Se recomienda un intervalo de 12 horas antes de la infusión y al menos 3 horas después de la infusión antes de la administración del sustrato OATP1B1. Se debe evitar la vacunación con una vacuna viva atenuada en pacientes que reciben cabazitaxel. Se pueden usar vacunas muertas o inactivadas, pero la respuesta a tales vacunas puede verse disminuida.
La preparación contiene la sustancia: Cabazitaxel
Medicamento reembolsado: NO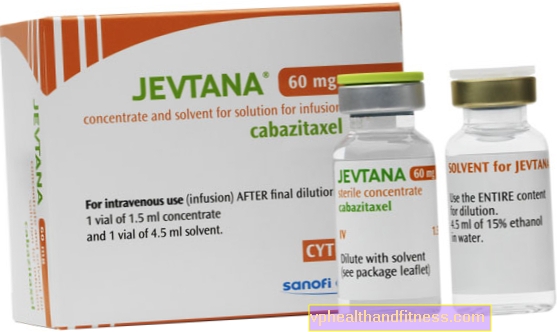

.jpg)



.jpg)